翻译中迷失:“危险的”氨基酸如何中止蛋白质合成的延伸
发布时间:2023-01-09 点击数:1139
摘要:东京工业大学和兵库大学的研究人员发现,蛋白质合成翻译过程中的一个关键步骤,会被真核细胞中含有大量N端天冬氨酸和谷氨酸残基的氨基酸序列破坏。该团队的研究结果表明,这些“危险的”氨基酸可以破坏核糖体机制的稳定。因此,大多数蛋白质组倾向于避免在肽序列的N端合并它们,这表明氨基酸分布存在偏差。
生命依赖于核糖体在细胞中合成的几种蛋白质的精确功能。这种多样的蛋白质组被称为蛋白质组,由核糖体中发生的氨基酸序列的稳健翻译延伸维持。在 生物体中,确保多肽的新生链(氨基酸的长链)被拉长而不被分离的翻译机制是保守的。然而,伸长率不是恒定的。带正电的新生多肽和带负电的核糖体RNA之间的相互作用通常会中断延伸。
研究发现,在原核生物细胞中,新生的肽链不仅破坏了延伸过程,而且破坏了核糖体本身的稳定。这种类型的转换被称为过早终止内在核糖体失稳(IRD). 有证据表明,IRD主要由n末端富含天冬氨酸和谷氨酸序列的新生多肽触发。由于翻译机制是保守的,研究人员开始怀疑是否在真核生物(如植物、真菌和动物)的细胞中也能看到类似的现象。
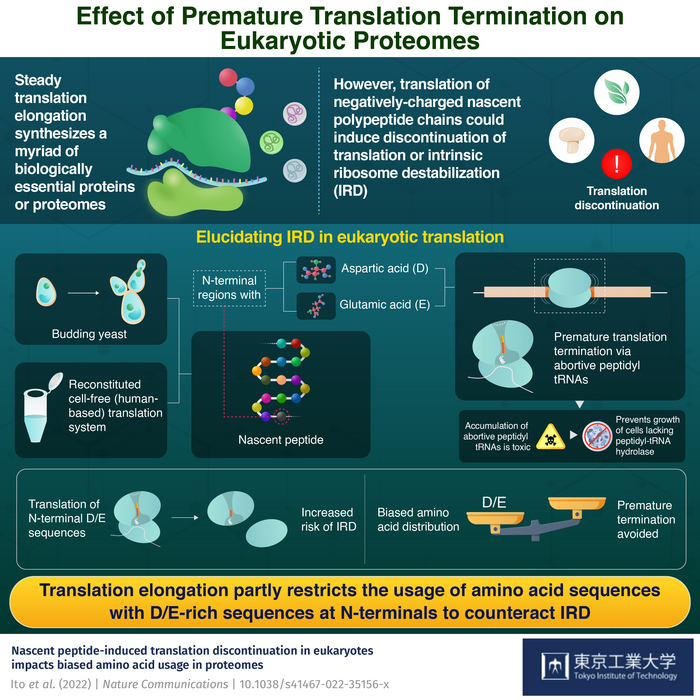
图1 过早翻译终止对真核细胞蛋白质组的影响(图源:东京工业大学)
由东京工业大学(Tokyo Tech)田口秀树教授(Hideki Taguchi)领导的日本研究团队成功地为这个问题提供了一些答案。在他们 发表在《自然通讯》上的研究中,该团队使用出芽酵母细胞和重建的细胞游离翻译系统来研究真核生物中的IRD现象。“以前的研究已经探索了天冬氨酸和谷氨酸序列对细菌核糖体翻译的影响。然而,关于真核细胞的研究并不多。因此,我们选择了像酵母这样的真核生物来研究翻译的过早终止,以及是否存在任何对抗IRD的机制,”该研究的通讯作者之一田口教授解释说。

图2 研究发现,在原核生物细胞中,新生的肽链不仅破坏了延伸过程,而且破坏了核糖体本身的稳定。
研究小组发现,与细菌类似,在酵母细胞的n端区域富集天冬氨酸(D)或谷氨酸(E)的新生肽链导致IRD在酵母细胞中的翻译流产。他们还发现,肽基- trna的积累抑制了缺乏肽基- trna水解酶的酵母的细胞生长,肽基- trna水解酶是一种必需的细胞酶。IRD产生的肽基- trna被肽基- trna水解酶裂解,该酶在核糖体复合物外回收肽基- trna。这些流产肽基trnas的积累是有毒的,因为缺乏这种酶的酵母在ird倾向的序列过表达时不能生长,”田口教授说。
然而,该团队进行的生物信息学分析揭示了酵母细胞降低IRD风险的独特方式。他们发现蛋白质组具有偏倚的氨基酸分布,其中翻译延伸过程不利于在其n端区域运行D/E的氨基酸序列。
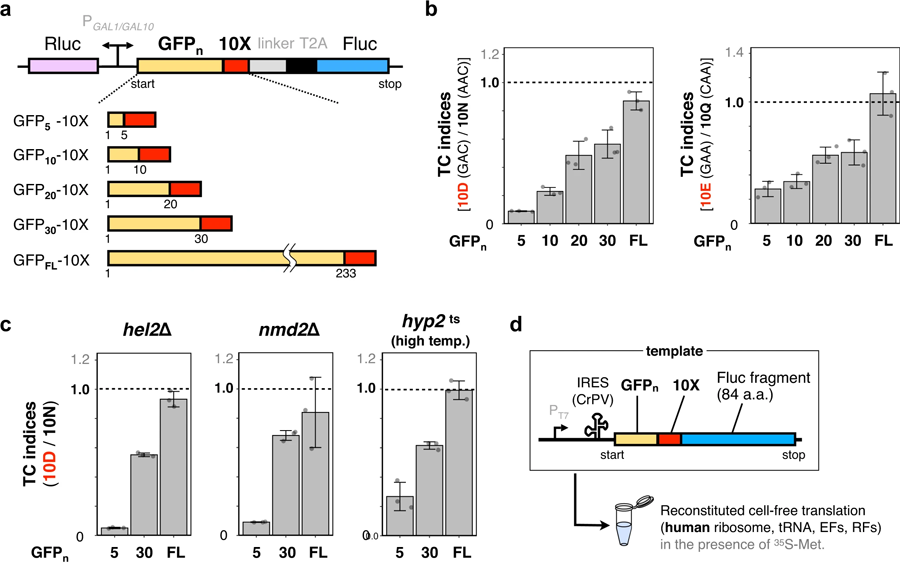
图3 N末端区域中连续带负电荷的氨基酸过早终止翻译(图源:[1])
这项研究为真核细胞的延伸动力学和减少蛋白质合成过程中翻译缺陷的抵消机制提供了新的见解。“了解影响蛋白质组中氨基酸整体使用的因素可以帮助我们提高重组蛋白的表达。这对于生产具有临床和工业应用价值的有用蛋白质至关重要,”田口教授总结道。
参考资料:
[1] Nascent peptide-induced translation discontinuation in eukaryotes impacts biased amino acid usage in proteomes