CAR-T全链条关键产品及服务解决方案
发布时间:2025-10-11 点击数:111
CAR-T细胞治疗已成为生物医药领域最具颠覆性的前沿方向,其产业化浪潮的兴起,高度依赖于一个成熟、高效且稳定的全链条产业链生态的支撑。在这一复杂链条中,涉及靶点发现与验证、体外/体内模型构建等基础研究,更依赖于一系列关键工具与服务的突破,如高精度基因编辑技术、类器官与PDX模型等,这些构成了细胞治疗从实验室走向产业化的基石。

西宝生物作为中国生命科学研发与生产领域的知名供应商,其在细胞治疗领域的优势并非直接从事细胞药物研发或生产(如CDMO),而是聚焦于“核心原材料供应链”和“技术服务与解决方案”的提供。其平台优势可以概括为:一体化的产品组合、强大的本土化服务能力、以及对质量体系的严格把控,为细胞治疗企业从研发到生产全过程降本增效、规避供应链风险提供关键支撑。
一、早期研发环节
1. 靶点蛋白与检测工具
细胞治疗的靶点蛋白可根据肿瘤类型分为血液瘤靶点和实体瘤靶点,不同靶点的发现与应用有力推动了细胞治疗在各类癌症领域的突破性进展。
在血液瘤领域,以CD19、BCMA和CD20为代表的经典靶点已在CAR-T治疗血液系统恶性肿瘤中广泛应用。例如,靶向CD19的CAR-T产品在治疗急性淋巴细胞白血病和弥漫性大B细胞淋巴瘤等疾病中展现出卓越疗效;而以BCMA为靶点的细胞治疗产品,则为多发性骨髓瘤提供了新的治疗方向,目前已有相关产品投入临床使用。
实体瘤因肿瘤微环境复杂、异质性高等因素,其靶点开发面临更大挑战。然而,Claudin 18.2、GPC3、MSLN等新兴靶点的发现,为实体瘤细胞治疗开辟了新路径。其中,Claudin 18.2在胃癌、胰腺癌等消化道肿瘤中呈现高表达,已成为实体瘤细胞治疗的重要研究方向;GPC3则在肝癌中特异性表达,为肝癌的细胞治疗药物研发提供了关键科学依据。
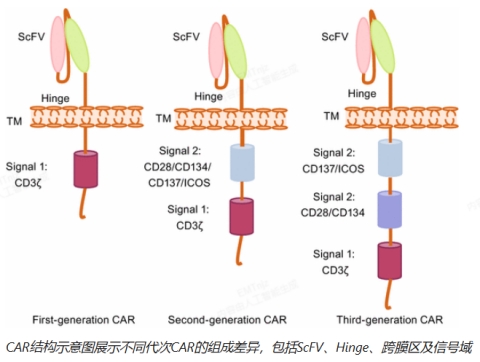
检测工具与技术
Star Staining 荧光标记蛋白采用先进荧光标记技术,能够对靶点蛋白实现高灵敏度与高特异性的可视化检测,在细胞层面精确解析其表达与分布特征,为靶点筛选与验证提供直观、可靠的实验依据。
通用型 CAR 检测工具主要包括抗 G4S/Whitlow Linker 抗体和 Protein L,广泛应用于 CAR 分子的表达验证和质量控制。其中,抗 G4S/Whitlow Linker 抗体可特异性识别 CAR 分子中的连接区,而 Protein L 则能高效结合 CAR 的 ScFv 区域,从而实现对 T 细胞表面 CAR 表达水平的有效检测。
MHC-多肽复合物可用于评估细胞治疗产品的免疫原性风险。该工具通过模拟体内 MHC 分子抗原提呈过程,预测 CAR-T 细胞等治疗产品可能引发的免疫排斥反应,为临床前及临床研究阶段的安全性评价提供关键数据支持。
2. 评估与分析平台
在疾病模型方面,目前已建立起覆盖多种疾病类型的评价体系。血液瘤模型通常采用免疫缺陷小鼠输注肿瘤细胞的方式,模拟体内瘤生长及扩散过程;而实体瘤模型则涵盖瘤异种移植模型(PDX)和细胞系异种移植模型(CDX)等,能够模拟实体瘤的复杂微环境及生长特性,用于评价细胞治疗产品对实体瘤的杀伤效果。
在分析工具与服务方面,免疫组化抗体是重要的检测工具之一。针对Claudin-18.2、TROP2、PSMA等靶点的特异性抗体,能够通过免疫组化技术检测靶点在肿瘤组织中的表达与分布情况。例如,PSMA抗体可应用于前列腺癌组织中PSMA靶点的特异性检测,为相关药物研发提供关键技术支持。
二、CMC 生产环节
1. 关键原料供应
在细胞治疗产品的开发与生产中,GMP级别的细胞因子(如IL-2、IL-7、IL-15、IL-18和IL-21)对T细胞和NK细胞的扩增具有关键作用。例如,IL-2能够有效促进T细胞的活化与增殖,而IL-15则可显著增强NK细胞的杀伤活性并延长其存活时间。
基质蛋白细胞提供了必要的生长附着界面和适宜的微环境,提高了培养过程的稳定性和效率。在iPSC(诱导多能干细胞)培养中,Laminin系列蛋白(如Laminin 521、Laminin 511和Laminin 111)被广泛应用。其中,Laminin 521能够有效支持iPSC的贴壁生长与自我更新;针对悬浮培养的需求,开发出适配的Laminin体系,以支持iPSC的大规模扩增。另一方面,Fibronectin(纤连蛋白)和Vitronectin(玻连蛋白)作为经典的基质蛋白,在多种免疫细胞和干细胞的培养中发挥重要作用。
2. 工艺支持技术
细胞激活与编辑
CD3/CD28 磁珠:作为高效 T 细胞激活工具,CD3/CD28 磁珠通过模拟体内 T 细胞活化信号(CD3 介导的抗原识别信号、CD28 介导的共刺激信号),可快速激活静息 T 细胞,且激活效率高、细胞活性维持时间长,是 CAR-T 细胞生产中 T 细胞活化的主流工具。
基因编辑系统:Cas9/Cas12a 核酸酶等基因编辑工具,支持对细胞基因组进行精准修饰。例如,通过 Cas9 介导的基因敲除技术,可破坏 T 细胞中的 PD-1 基因,增强 T 细胞对肿瘤细胞的杀伤抵抗能力;或敲入 CAR 基因,构建靶向性 CAR-T 细胞,该系统具有编辑效率高、脱靶风险低的特点,满足临床级细胞治疗产品的生产要求。
三、CMC 质量控制环节
1. 检测试剂与平台
在CAR表征方面,目前主要采用荧光标记靶点蛋白和抗Linker抗体等技术手段。针对CD19、BCMA、GPC3等常见靶点开发的荧光标记蛋白,可通过流式细胞术检测CAR-T细胞表面分子与靶点的结合能力,从而量化CAR的表达水平和结合活性,确保其功能正常。此外,针对CAR结构中的G4S、Whitlow Linker等连接片段开发的抗Linker抗体,能够通过Western Blot和免疫荧光等技术检测CAR分子的完整性和表达稳定性,有效避免因Linker断裂导致的CAR功能异常。
在安全性检测方面,重点包括内毒素和工艺残留物的检测。采用重组C因子法进行内毒素检测,具有高特异性和灵敏度(最低检测限可达0.005 EU/mL),能够精准检测细胞治疗产品中可能存在的细菌内毒素,避免由此引发的发热、休克等不良反应。同时,针对DNA(如病毒载体DNA、基因编辑工具DNA)、BSA及抗生素等工艺残留物,开发出专用的检测试剂盒。
2. 质控工具与标准
报告基因系统通过构建含有荧光素酶、GFP等报告基因的功能细胞株,为细胞水平的快速定量检测提供有效手段。在CAR-T细胞药效评价中,通过在肿瘤细胞中使报告基因与靶点蛋白共表达,可根据报告基因的信号强度快速、定量地评估CAR-T细胞对肿瘤细胞的杀伤效率,显著缩短药效评估的周期。
基因编辑细胞株则利用基因编辑技术构建靶点基因敲除或敲入的细胞模型,广泛应用于靶点验证与机制研究。例如,通过构建特定靶点蛋白敲除的肿瘤细胞株,并与野生型细胞进行对比,能够明确CAR-T细胞的杀伤作用是否依赖于该靶点,从而验证其作用特异性。同时,这类基因编辑细胞株也为评估基因编辑工具的安全性(如脱靶效应)提供了关键实验模型。
四、临床研究支持
药效评价方面,Star Staining 荧光标记技术被用于体内药代动力学追踪。例如,在临床前动物实验中,利用荧光标记的CAR-T细胞,结合活体成像系统,可监测细胞在动物体内的分布、迁移、存活及增殖动态,尤其能够直观反映CAR-T细胞在肿瘤组织的富集情况与持续效力。肿瘤类器官模型作为一种高度模拟体内肿瘤组织结构及微环境的新型工具,可用于评估细胞治疗产品对不同患者来源肿瘤的杀伤效果,有效提升药效预测的临床相关性和准确性。
安全性评价中,免疫原性尤其是细胞因子释放综合征(CRS)的风险评估尤为重要。目前已建立CRS风险预测模型,通过体外共培养体系(如CAR-T细胞与肿瘤细胞共培养)检测IL-6、TNF-α等关键炎症因子的释放水平,并结合动物模型中实际观察到的CRS症状,系统分析细胞因子水平与毒副作用严重程度之间的关联,从而对临床应用中CRS发生的潜在风险进行科学预测。
产品列表
分类 | 货号 | 产品 |
CAR靶蛋白 | EKK7824A | 重组人 CD19 蛋白(Fc Chimera Active) |
EKK8142A | 重组人 CD20 蛋白 | |
EKJ6788A | 重组人BCMA蛋白 | |
检测工具 | ECL0018C | 重组蛋白L |
免疫组化抗体 | EKM5508A | 抗Claudin18.2抗体 |
EKM5820A | 抗TROP2抗体 | |
ECW9308A | 抗PSMA抗体 | |
细胞因子与培养基 | ECL0502A | 重组人IL-2 |
EDD0800A | 重组人IL-15 | |
DXA0083A | 杂交瘤细胞无血清培养基 | |
基质蛋白 | 人层粘连蛋白 521 | |
人层粘连蛋白511 | ||
EKK8223A | 重组人纤连蛋白Fibronectin | |
EKM1304A | 重组人玻连蛋白 Vitronectin | |
细胞激活及编辑 | CD3 磁珠 | |
CD28 磁珠 | ||
DAH0001A | Cas9 核酸酶 | |
安全性检测 | 重组C因子内毒素检测试剂盒 (96 Tests) | |
CHO残留DNA试管扩增检测试剂盒 | ||
CHO HCP残留检测试剂盒 (96 Tests) | ||
牛血清白蛋白残留检测试剂盒 (96 Tests) | ||
药效检测 | EBS0001A | 肠癌类器官培养基 |
EBS0001B | 人肠癌类器官培养基 | |
EBS0002A | 胃癌类器官培养基 | |
EBS0002B | 人胃癌类器官培养基 | |
EBS0003A | 肺癌类器官培养基 | |
EBS0004A | 乳腺癌类器官培养基 | |
EBS0005A | 肝实质细胞癌类器官培养基 | |
细胞培养 | 高纯度NK培养试剂盒 | |
CIK细胞扩增试剂盒 | ||
细胞分离 | ACJ0020A | Polysucrose 400 聚蔗糖400 |
细胞抗结团 & 表面活性剂 & 消泡剂 | DCJ0018D | 硫酸葡聚糖 5000(DSS),低内毒素 |
DCJ1606D | Seebiozcsb® 硫酸葡聚糖钠盐 40,000(DSS),低内毒素 | |
DCH0535A | Seebio® P188 非离子表面活性剂(100×) | |
ACH0497B | 泊洛沙姆188(药用级) | |
DGF6890 | 亚油酸钠 | |
ABY0110A | 金精三羧酸铵盐 | |
ACH0558A | 有机硅消泡剂 | |
ACH0476A-500g | 非离子型T-F复合型发酵用消泡剂 | |
细胞培养添加剂 | EYY3311 | 重组人胰岛素 |
DBM0012 | 转铁蛋白 | |
DCL0001 | 牛血清白蛋白 |
参考:
1. Hua Li, Yangbing Zhao. Increasing the safety and efficacy of chimeric antigen receptor T cell therapy. Protein Cell. 2017 Aug;8(8):573-589.
2. Christina Kratzmeier, Sasha Singh, et al. Current Developments in the Preclinical and Clinical use of Natural Killer T cells. BioDrugs 37, 57-71 (2023).
上一篇:StemRNA第三代重编程试剂盒
下一篇:用于干细胞研究的小分子化合物