蛋白酶K / Proteinase K(CAS:39450-01-6)(from Tritirachium album limber)
发布时间:2023-11-27 点击数:263

简介
蛋白酶k是一种枯草蛋白酶类的高活性蛋白酶,用于生物样品中蛋白质的一般降解。从林伯氏白色念球菌(tritirachium album limber)中纯化得到。蛋白酶K是一种切割活性较广的丝氨酸蛋白酶。它切割脂族氨基酸和芳香族氨基酸的羧基端肽键。此酶经纯化去除了RNA酶和DNA酶活性。由于蛋白酶K在尿素和SDS中稳定,还具有降解天然蛋白质的能力。
应用
- ◆ 基因诊断试剂盒
- ◆ 基因组DNA提取试剂盒
- ◆ RNA提取试剂盒中去除DNA和RNA制备中的核酸酶
- ◆ 提取组织中非蛋白成份降解含有蛋白质的杂质-譬如DNA疫苗和功能成分的制备
- ◆ 制备脉冲电泳的染色体DNA
- ◆ 蛋白质印迹
- ◆ 蛋白酶K的一般工作浓度50-100ug/ml
西宝生物专业提供蛋白酶K Proteinase K(CAS:39450-01-6),客服热线:400-021-8158。
质量指标
品名 | 蛋白酶 K / Proteinase K |
来源 | 林伯氏白色念球菌(Tritirachium album limber) |
外观 | 白色冻干粉 |
比活 | >30U/mg蛋白 |
分子量 | 29,730 |
CAS No. | 39450-01-6 |
EC No | 3.4.21.14 |
活性单位定义 | 37℃、pH 7.5条件下,每分钟可水解底物酪蛋白生成1μmol酪氨酸的蛋白酶K的量,定义为一个单位(U)。 |
DNase残留 | 以λDNA为底物,37℃消化6小时以上,未检测到脱氧核糖核酸酶活性。 |
RNase残留 | 25℃消化16小时以上,未检测到核糖核酸酶活性。 |
失活方法 | 反应体系中加入PMSF或DFP抑制剂即可失活,65℃温育10-15min可部分失活 |
包装 | 100mg,1g,10g,1kg 大包装询价 |
储存
干粉状态可在0~4℃条件下低温保藏。溶解后分装为适当体积,-20℃贮存。运输可在室温下进行。正确的贮存条件下,干粉状态的有效期可达一年。液体状态在-20℃有效期为半年。打开包装使用后,如果在2~8℃环境下放置超过一周时间,建议过滤除菌或增加稳定剂如0.5%叠氮化钠,防止微生物污染。
贮存和稀释缓冲液:50mM Tris-HCl缓冲液,2mM CaCl2 (pH 8.0)。
反应条件:反应缓冲液中37-56℃温育一小时
反应条件:反应缓冲液中37-56℃温育一小时
实验数据
1. 酶活测定和稳定性试验
(1) 酶活测定
试剂准备
试剂 I: 底物:1%牛奶乳酪蛋白溶液。1 g牛奶乳酪蛋白溶于50 ml 0.1 M磷酸钠盐溶液,pH 8.0,65-70 ℃水域孵育15 min搅拌溶解,自来水冷却,氢氧化钠调节pH 8.0,定容100 ml。
试剂 II: TCA溶液:0.1 M三氯乙酸,0.2 M乙酸钠,0.3 M乙酸,HCl调节pH 4.03,定容100ml。
试剂 III:0.4 M碳酸钠溶液。
试剂 IV: 福林酚试剂:用水5倍稀释。
试剂 V: 酶稀释液:0.1 M磷酸钠盐溶液,pH 8.0。
试剂 VI: 酪氨酸溶液:1 μg/ml酪氨酸,0.2 M HCl溶解。
试剂 II: TCA溶液:0.1 M三氯乙酸,0.2 M乙酸钠,0.3 M乙酸,HCl调节pH 4.03,定容100ml。
试剂 III:0.4 M碳酸钠溶液。
试剂 IV: 福林酚试剂:用水5倍稀释。
试剂 V: 酶稀释液:0.1 M磷酸钠盐溶液,pH 8.0。
试剂 VI: 酪氨酸溶液:1 μg/ml酪氨酸,0.2 M HCl溶解。
操作步骤
1.0.5 ml试剂I 37 ℃孵育10 min,加入0.5 ml酶液,混匀,37 ℃反应10 min;
2.加入1 ml试剂II终止反应,混匀,继续孵育30 min;
3.离心反应液;
4.取0.5 ml上清液,加入2.5 ml 试剂III,0.5 ml试剂IV,混匀后37 ℃孵育30 min;
5.660 nm 测定OD1;空白对照组:0.5 ml试剂V代替酶液,测定OD2;
6.0.5 ml试剂VI,2.5 ml 试剂III,0.5 ml试剂IV,混匀后37 ℃孵育30 min。660 nm 测定OD3;
空白对照组:0.5 ml 0.2 M HCI代替试剂VI,测值为OD4。
2.加入1 ml试剂II终止反应,混匀,继续孵育30 min;
3.离心反应液;
4.取0.5 ml上清液,加入2.5 ml 试剂III,0.5 ml试剂IV,混匀后37 ℃孵育30 min;
5.660 nm 测定OD1;空白对照组:0.5 ml试剂V代替酶液,测定OD2;
6.0.5 ml试剂VI,2.5 ml 试剂III,0.5 ml试剂IV,混匀后37 ℃孵育30 min。660 nm 测定OD3;
空白对照组:0.5 ml 0.2 M HCI代替试剂VI,测值为OD4。
活力计算
公式说明:
2: 反应液总体积(mL);
0.5: 酶液体积(mL);
10: 反应时间(min);
df: 稀释倍数;
181.2: 酪氨酸分子量;
C: 酶浓度( mg/mL)。
2: 反应液总体积(mL);
0.5: 酶液体积(mL);
10: 反应时间(min);
df: 稀释倍数;
181.2: 酪氨酸分子量;
C: 酶浓度( mg/mL)。
结果比较
蛋白酶K特异活性 | ||
制造商 | 国外M品牌 | Seebio |
冻干产品活性 u/mg | 33.5 | 49.5 |
(2)纯度和消化蛋白测试(SDS-PAGE)
结果: 蛋白质纯度超过 99% (激光扫描 SDS-PAGE胶)
(3) 稳定性测试:
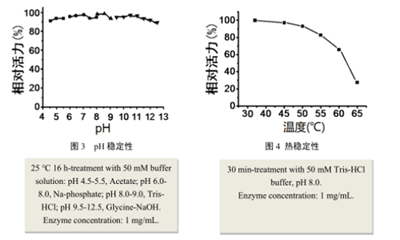
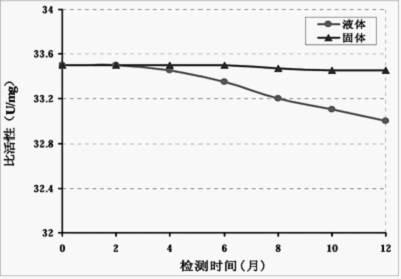
结论:冻干粉正确储存一年内活性不变;液体酶酶活半年内降低小于5%。
2. 对比试验
以Roche蛋白酶K和seebio蛋白酶K对比。
对比反应条件:roche蛋白酶k 65℃ 10m; Seebio 蛋白酶k 65℃ 10m; Seebio蛋白酶K 55℃ 60m
以下结果QC符合要求。每管均为500ul全血。共3组对照。
实验条件 | 得率 | ||
ROCHE65℃10m | 33ug | 19.2ug | 5ug |
SEEBIO65℃10m | 30ug | 20ug | 4.8ug |
SEEBIO55℃60m | 30.4ug | 18.5ug | 5.4ug |
全血提取DNA试剂盒电泳图 | 全血提取DNA actin电泳图 |
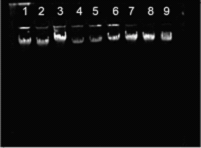 | 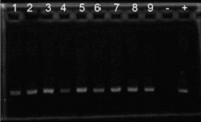 |
日期:2010.06.09 凝胶浓度:0.7%琼脂糖RNA胶 上样量:1ug/孔 电泳条件:U=105V T=15min 1. 090826-15(roche,65℃ 10m) 2. 090826-15(seebio,65℃ 10m) 3. 090826-15(seebio,55℃ 60m) 4. 090826-17(roche,65℃ 10m) 5. 090526-17(seebio,65℃ 10m) 6. 090826-17(seebio,55℃ 60m) 7. 090826-20(roche,65℃ 10m) 8. 090826-20(seebio,65℃ 10m) 9. 090826-20(seebio,55℃ 60m) | 日期:2010.06.10 凝胶浓度:0.7%琼脂糖DNA胶 上样量:10ug/孔 电泳条件:U=95V T=15min 1. 090826-15(roche,65℃ 10m) 2. 090826-15(seebio,65℃ 10m) 3. 090826-15(seebio,55℃ 60m) 4. 090826-17(roche, 65℃ 10m) 5. 090526-17(seebio, 65℃ 10m) 6. 090826-17(seebio, 55℃ 60m) 7. 090826-20(roche, 65℃ 10m) 8. 090826-20(seebio, 65℃ 10m) 9. 090826-20(seebio, 55℃ 60m) -:Negative control +:Positive Control |
结论:SEEBIO 蛋白酶K与ROCHE蛋白酶k实验结果显示在65℃水浴10m后得率及跑胶图效果基本相同。可替代使用。
参考文献
1. Kraus, E; et.al. Proteinase K from the Mold Tritirachium album limber, Specificity and Mode of Action. Z. Physiol. Chem., 357:939; 1976.
2. Jany,KD, et al. Amino Acid Sequence of Proteinase K from the Mold, Tritirachium album limber. Proteinase K; a Subtilisin-related Enzyme with Disulfide Bonds. FEBS Letter, 199,139.1986.
3. Sambrook, J., Fritsch, E.F. and Maniatis, T. (1989) Molecular Cloning: A Laboratory Manual, Volume 3, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, B.16.
4. Sweeney, P.J. and Walker, J.M. (1993) Enzymes of molecular biology. In: Methods in Molecular Biology, Vol. 16, M.M. Burrell, ed., Humana Press, Inc., Totowa, NJ, 305.
2. Jany,KD, et al. Amino Acid Sequence of Proteinase K from the Mold, Tritirachium album limber. Proteinase K; a Subtilisin-related Enzyme with Disulfide Bonds. FEBS Letter, 199,139.1986.
3. Sambrook, J., Fritsch, E.F. and Maniatis, T. (1989) Molecular Cloning: A Laboratory Manual, Volume 3, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, B.16.
4. Sweeney, P.J. and Walker, J.M. (1993) Enzymes of molecular biology. In: Methods in Molecular Biology, Vol. 16, M.M. Burrell, ed., Humana Press, Inc., Totowa, NJ, 305.
西宝生物专业团队热忱为您服务!