抗体稀释缓冲液选择及应用
发布时间:2024-11-22 点击数:644
抗体稀释缓冲液是一种用于稀释抗体的溶液,通常在免疫实验中使用,如Western Blot、免疫荧光(IF)、免疫组化(IHC)等。抗体稀释缓冲液的主要作用是防止抗体效价下降,减少非特异性吸附,并提高实验的特异性和灵敏度。
抗体稀释缓冲液的配方和成分根据不同的实验需求有所不同。一些缓冲液中会添加牛血清白蛋白(BSA)作为稳定剂,以防止抗体在稀释过程中失活。此外,某些缓冲液还可能包含防腐剂如叠氮钠,以延长稀释液的保存时间。
主要作用
维持抗体稳定性:提供一个适宜的pH值和离子强度环境,防止抗体变性或失活。
降低非特异性结合:减少抗体与非目标蛋白或基质的结合,提高实验的特异性。
优化抗体与抗原的结合:通过调节缓冲液的成分,可以影响抗原-抗体反应的效率。
抗体稀释液产品 | 说明 | 应用 |
抗体稀释液(普通型) | 抗体稀释液(普通型)(Antibody Dilution Buffer)用于普通抗体的稀释,可防止抗体效价下降,减少抗体非特异性吸附。稀释后的抗体在4℃可以短期保存,抗体的效价会随时间而下降。 | 按照适当比例稀释抗体,例如 1:1000,即将1μl抗体加入到1ml稀释液中。抗体稀释后可直接用于实验,在一次孵育结束后,可以回收稀释的抗体,4℃短期保存,以用于下次的实验,但抗体的效价会随时间而降低。 |
封闭用抗体稀释液 | 抗体稀释液中添加了抗体保护剂,可以保持抗体的活性和稳定性,减少特异性结合,降低非特异性的背景着色,提高实验的特异性和灵敏度。主要成分由Tris-HCl缓冲液、牛血清白蛋白、叠氮钠组成。 | 封闭 |
通用型免疫测定抗体稀释液 | 抗体稀释液用在 免疫测定中稀释抗体。不含免疫球蛋白BSA,不含磷酸盐。可用于稀释 抗体,包括过氧化物酶偶联物和针对磷蛋白的抗体。不适合稀释针对S100蛋白的抗体。 | 用于稀释一抗或二抗。稀释后的抗体可在2-8℃下保存数周。该通用抗体稀释缓冲液已被用于血液学及组织学研究的免疫印迹。 |
免疫组化用抗体稀释缓冲液 | 对组织或3D细胞培养物执行免疫组化(IHC)研究。该缓冲液由含0.2%吐温20、功能成分、3%驴血清和5%DMSO的PBS组成。有助于抗体穿透至组织并封闭非特异性信号,有助于在 组织或3D细胞培养物深度下实现清晰、明亮成像。可快速透明化用于3D成像的荧光标记组织,顶值限度地减少组织皱缩、膨胀或其他形态学变化,与大多数荧光基团(包括染料和荧光蛋白)兼容。 | 抗体稀释缓冲液用于稀释一抗或二抗。 |
抗体稀释缓冲液的pH值通常为7.0至7.4,这是因为这个范围内的缓冲液能够更好地保持抗体的活性和结合特性。此外,缓冲液中的离子强度也会影响抗体的结合效果,因此在选择稀释缓冲液时需要考虑这些因素。
在使用抗体稀释缓冲液时,通常需要根据抗体的效价和实验的具体要求进行稀释。一抗的稀释比例可能从1:100到1:1000不等,稀释后的抗体可以短期保存在4℃下,但效价会随时间逐渐降低。
实验一、
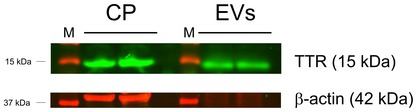
胞外囊泡鉴定外周炎症期间血脑通讯的新机制
试验二、
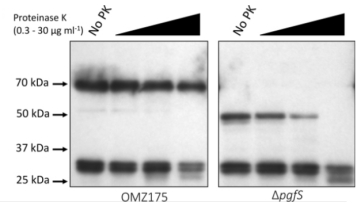
参与变形链球菌表面蛋白翻译后修饰的 pgf 操纵子的表征
抗体稀释缓冲液中pH值和离子强度影响
pH值的影响
pH值对抗体的稳定性有显著影响。研究表明,当pH值大于6.5或小于8.5时,抗原抗体结合效率会受到严重影响。极端的pH值会导致抗体分子变性,破坏抗原识别表位,从而降低抗原抗体的结合效率。
抗体的互补决定区(CDR)在pH 7.4-7.6时形成强结合,但在pH 7时仅形成弱结合。这表明pH值在特定范围内对抗体的结合能力有显著影响。天冬氨酸组成的CDR对pH变化敏感,随着pH值的升高,免疫球蛋白之间的蛋白质-蛋白质相互作用增强。
离子强度的影响
离子强度通过静电相互作用影响抗体与分析物的结合。当离子强度低于0.005 M PBS时,IC50显著增加;而当离子强度高于0.01 M PBS时,IC50大幅降低。这表明盐类会与抗体竞争,通过静电相互作用与分析物竞争,从而降低分析的可检测性。
大多数稀释液含有毫摩尔量的氯化钠或其他盐,以减少带电分子之间的非特异性相互作用。然而,过强的离子强度应避免,因为它可能会克服高亲和力抗体-表位结合所需的特定电荷相互作用。
注意事项
抗体稀释缓冲液通常可在4℃下保存数月,使用前建议过滤以去除颗粒物,同时,针对特定实验需求,可能需要对缓冲液的配方进行优化以获得适合效果。
* 部分内容来自网络及论文
参考文献
1. Zh. Tian, et alDevelopment and optimization of an indirect enzyme-linked immunosorbent assay for 19-nortestostero.Journal of Animal and Feed Sciences, 17, 200
2. Nina Hahn, et al. Protecting RNA quality for spatial transcriptomics while improving immunofluorescent staining quality. Front Neurosci. 2023 May 18:17:1198154
3. Balusu S, et al. Identification of a novel mechanism of blood-brain communication during peripheral inflammation via choroid plexus-derived extracellular vesicles. EMBO Mol Med. 2016 Oct 4;8(10):1162-1183.
4. Alejandro Avilés-Reyes, et al. Characterization of the pgf operon involved in the posttranslational modification of Streptococcus mutans surface proteins. Sci Rep. 2018 Mar 16;8(1):4705.